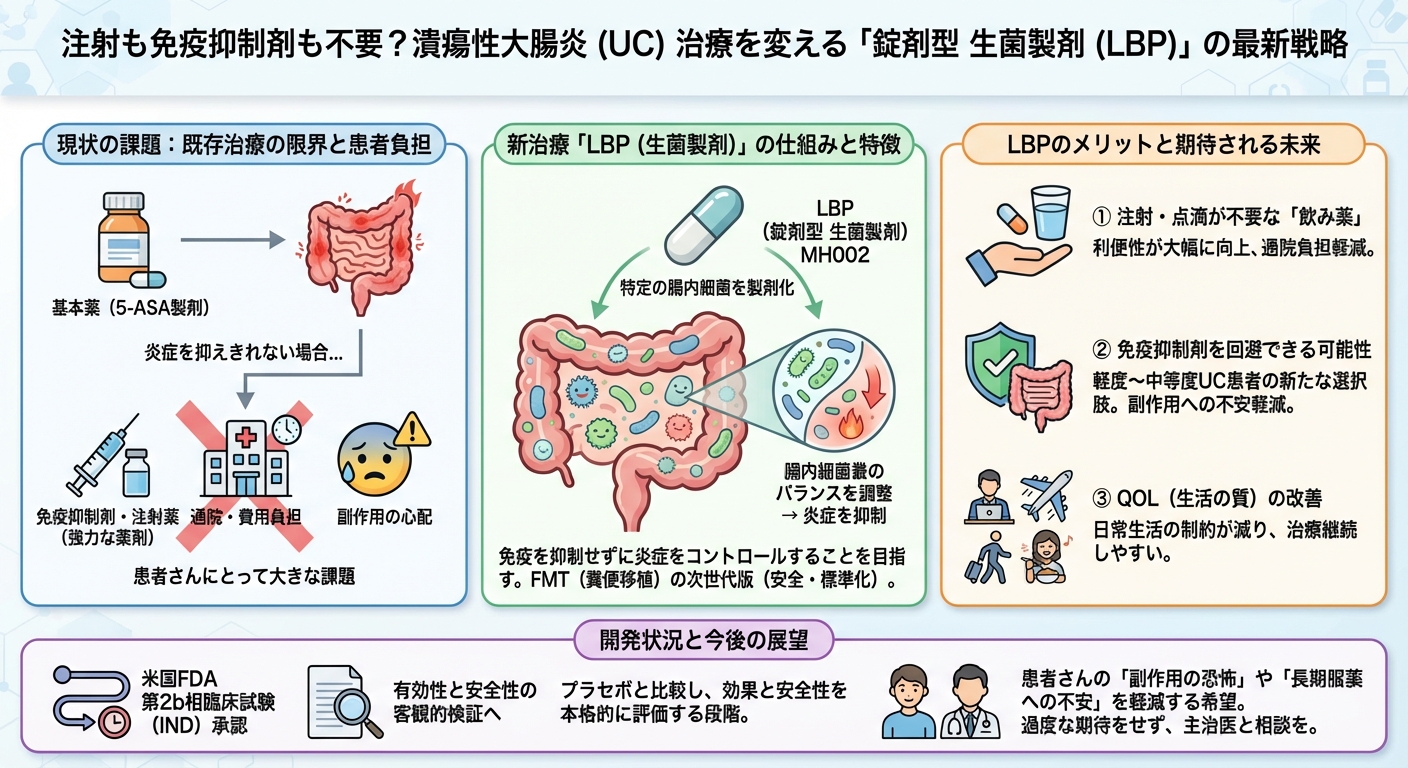
軽度から中等度の潰瘍性大腸炎(UC)の治療において、全く新しい経口薬の選択肢が加わる可能性が出てきました。MRM Health社は、特定の腸内細菌を製剤化した生菌製剤(LBP: Live Biotherapeutic Product)と呼ばれる新しいクラスの治療薬「MH002」について、米国FDAから第2b相臨床試験(治験薬申請:IND)の承認を取得し、本格的な開発を開始しました。
UC治療の基本薬である5-ASA製剤では炎症を抑えきれない場合、次に免疫抑制作用のある強力な薬剤や高額な注射薬に移行することが一般的ですが、患者さんにとって「副作用の心配」や「通院・費用負担」は大きな課題です。この新しい「腸内細菌薬」は、免疫を抑制することなく炎症をコントロールすることを目指しており、多くの患者さんの希望となる可能性があります。
この記事でわかる3つのこと
- FMT(糞便移植)の次世代版となる「生菌製剤(LBP)」とは何か。
- 軽度から中等度UCの治療戦略に、この新しい経口薬がどのような意味を持つのか。
- 患者さんが過度な期待をせず、この最新ニュースをどのように理解し、主治医と相談すべきか。
今回のニュースで押さえるべきポイント
-
全く新しい治療クラス「LBP(生菌製剤)」の開発が前進
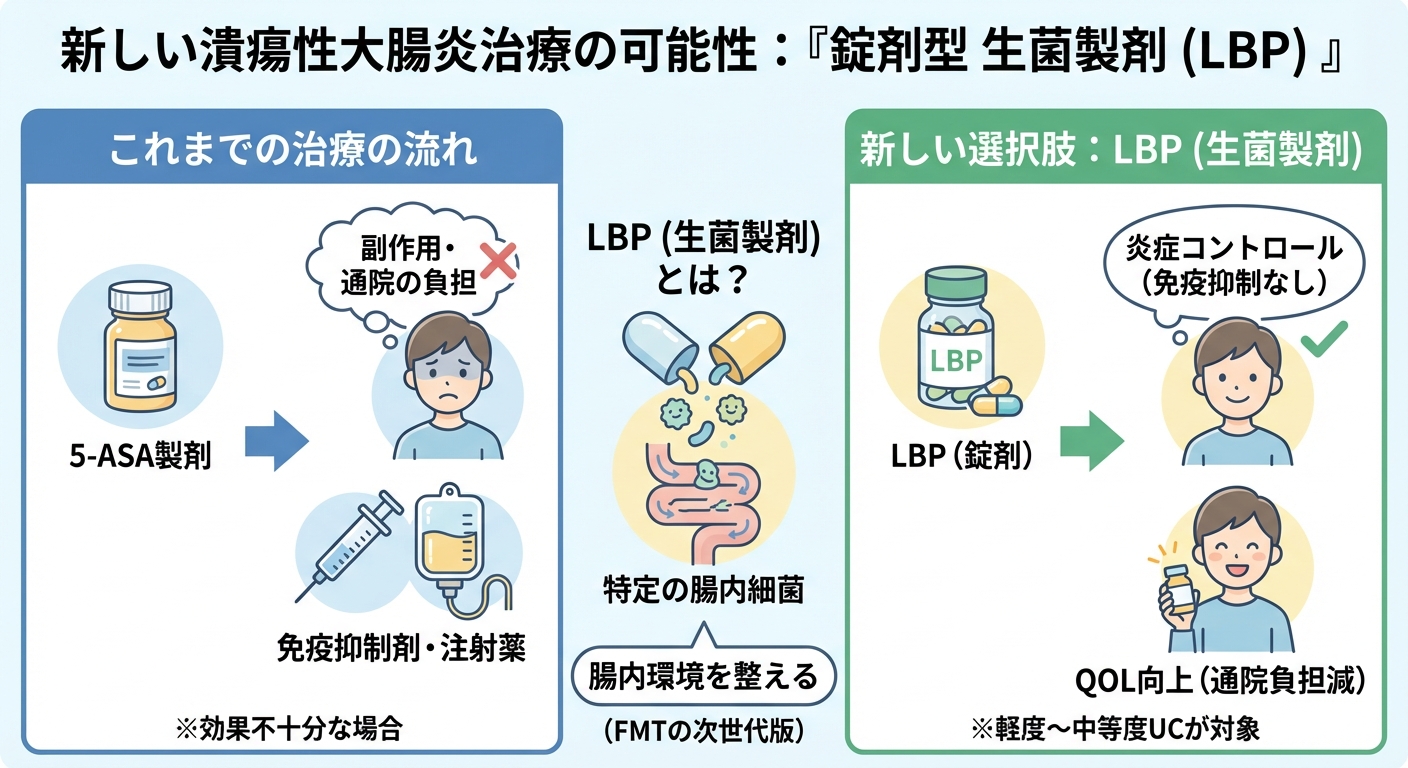
MRM Health社のMH002は、特定の腸内細菌の組み合わせをカプセルとして服用する「生菌製剤(Live Biotherapeutic Product)」です。これは、ドナーから糞便を移植する「糞便微生物叢移植(FMT)」から一歩進んだ、より安全で標準化された治療法として注目されています。この薬剤は、UCの病態に関わる腸内細菌叢のバランスを調整することで、炎症を抑えることを目指しています。
-
軽度から中等度のUC患者が主要な対象
この第2b相試験の対象は、軽度から中等度の潰瘍性大腸炎患者さんです。既存の5-ASA製剤(メサラジンなど)だけでは十分な効果が得られない患者さんに対し、免疫抑制薬や高額なバイオ製剤を使わずに済む、新しい経口薬の選択肢となることが期待されています。従来の治療段階のギャップを埋める重要な位置づけとなる可能性があります。
-
注射や点滴が不要な「飲み薬」として開発
MH002は、錠剤(カプセル)として服用できるように開発が進められています。これにより、通院して点滴や注射を受ける必要がなくなり、治療の利便性が大幅に向上します。日常の負担が軽減されることで、治療の継続しやすさ(アドヒアランス)が高まり、患者さんのQOL(生活の質)改善に直結することが期待されます。
-
治療効果と安全性の客観的検証へ
今回の米国FDAからの治験薬申請(IND)承認は、第2b相試験という、有効性の本格的な検証を行う段階への移行を意味します。この段階で、治療薬が本当に症状や炎症を抑えることができるのか、また、予期せぬ副作用がないかを、プラセボ(偽薬)と比較しながら客観的に評価することになります。
治療の現場と患者さんの生活に与えるインパクト
この新しい治療戦略は、潰瘍性大腸炎の治療体系全体に大きな変化をもたらす可能性を秘めています。特に、既存治療の限界に悩む患者さんにとって、大きな希望となるでしょう。
患者視点:日常生活(食事、仕事、トイレの不安)へのプラス面とマイナス面
軽度から中等度のUC患者さんにとって、最も怖いのは病態が悪化し、より強力な免疫抑制薬や生物学的製剤(バイオ製剤)が必要になることです。これらの薬は効果が高い一方で、感染症などの副作用リスクが伴うため、心理的な抵抗を感じる方も少なくありません。MH002がもし免疫抑制を伴わずに炎症を抑えることができれば、患者さんが抱える「副作用の恐怖」や「長期服薬への不安」を大きく軽減できる可能性があります。
また、飲み薬であるという利便性は、仕事や旅行といった日常生活における治療の制約を減らします。注射や点滴のために頻繁に通院する必要がなくなることで、生活の自由度が向上し、QOL(生活の質)の劇的な改善が期待されます。
筆者自信は、青黛(セイタイン)という生薬を服用して、潰瘍性大腸炎を抑えることができている。あくまでも認可されている薬や生薬ではないので、利用する際は、できれば医師に相談した上で、自己責任で利用してほしい。
医療者視点:既存薬(5-ASA、バイオ製剤等)との使い分けの可能性
現在のUC治療は、軽症の患者さんに対して5-ASA製剤(基本薬)を使い、効果が不十分な場合に、ステロイドやバイオ製剤、JAK阻害薬などへと段階的に移行する「ステップアップ治療」が主流です。しかし、5-ASA製剤と高度治療薬の間には、治療オプションに大きなギャップがあります。MH002が承認されれば、このギャップを埋める、「免疫抑制を伴わない次の一手」として位置づけられる可能性があります。これにより、特に軽度から中等度の患者さんに対して、より副作用リスクの低い治療を早期に提供できるようになるかもしれません。
社会・未来視点:このニュースが今後のUC治療のトレンドをどう変えるか
この生菌製剤(LBP)の開発進展は、UC治療が「腸内細菌叢(マイクロバイオーム)」という、病気の根源的な原因に迫る新しい時代に入ったことを示しています。これまで糞便移植(FMT)として研究されてきたアプローチが、製薬技術によって安全で標準化された錠剤へと進化することで、世界的にUC治療のトレンドが変化する可能性があります。また、高額なバイオ製剤の前に、より安価で利便性の高い治療選択肢が加わることは、医療経済的な負担の軽減にも繋がります。UC治療は、炎症抑制だけでなく、QOLの向上と長期的な生活の安心を追求する方向へとさらに加速していくでしょう。
期待できること
- 既存の5-ASA製剤で効果不十分な患者さんに対する、新たな経口薬の選択肢の増加。
- 免疫抑制を伴わない治療法の確立による、長期的な副作用リスクの軽減。
- 注射・点滴治療から解放されることによる、患者さんの通院負担と経済的負担の軽減。
現時点では不明なこと
- 第2b相試験での有効性(寛解導入率)と安全性(副作用)の具体的なデータ。
- 日本での臨床試験の開始時期や、国内での承認・実用化までの具体的なスケジュール。
- 重症度が高い患者さんや、すでに高度治療薬を使用している患者さんに対する効果の有無。
この情報の正確性
本ニュースは、MRM Health社が米国FDA(食品医薬品局)から、生菌製剤MH002の第2b相臨床試験開始の承認(IND承認)を取得したという公的なマイルストーンに基づいています。これは企業の一方的な発表ではなく、規制当局による治験計画の審査が完了したという事実であり、信頼性が極めて高い情報です。
研究デザインとしては、第2b相試験は有効性と安全性を本格的に評価するために、通常、プラセボ(偽薬)と比較するランダム化比較試験(RCT)として設計されます。これにより、MH002の効果を客観的かつ厳密に判断するための、信頼性の高いデータが得られると期待できます。
ただし、IND承認はあくまで「治験を開始して良い」という許可であり、現時点でMH002の有効性や長期的な安全性はまだ確立されていません。実用化、特に日本での承認までには、さらに大規模な第3相試験や各国の審査が必要であり、まだ数年を要する見込みです。
したがって、このニュースは「高い信頼性を持つ公的プロセスが始まった」という点で非常に重要ですが、個々の患者さんへの適応は主治医の判断が必要であることに変わりはありません。
誤解を防ぐための注意点
新しい治療法のニュースは大きな希望をもたらしますが、過度な期待は避け、冷静な判断を心がけることが大切です。
-
自己判断による治療中止は厳禁です
現在、5-ASA製剤やその他の薬で寛解を維持できている患者さんは、決して自己判断で服薬を中断しないでください。症状が落ち着いていても、粘膜に炎症(潜在性UC)が残っている可能性があり、中断は症状の急激な悪化や大腸がんリスクの増大につながります。治療方針の変更は必ず専門医と相談してください。
-
安全性と有効性は今後の試験で検証されます
生菌製剤(LBP)という新しい治療クラスは、既存の薬とは異なる作用機序を持つため、これまでの薬では予測できなかった特有の副作用リスクが発見される可能性があります。第2b相試験は、その有効性だけでなく、どのような患者さんに、どの程度の副作用が発生するかを詳しく検証することが目的です。最終的な結果が出るまで、情報収集を継続しましょう。
-
この薬は全てのUC患者さんを対象としているわけではありません
MH002の臨床試験は、主に軽度から中等度のUC患者さんを対象としています。重症度の高い患者さんや、炎症が非常に進行している患者さんに対して、この治療薬がどの程度有効であるかは、現時点では不明です。ご自身の病態(直腸型、左側型、全大腸炎型など)や重症度に合わせて、主治医と相談することが重要です。
Q&A
Q1. MH002が承認されたら、すぐに今の薬から切り替えるべきですか?
A. 仮にMH002が承認されたとしても、すぐに現在の治療を切り替える必要はありません。現在寛解を維持できている薬は、最も安全性が高い「あなたにとって有効な薬」だからです。MH002は、主に「5-ASA製剤では不十分だが、免疫抑制剤やバイオ製剤は使いたくない」という患者さんにとって、新たな選択肢として加わることになります。切り替えのタイミングや必要性については、必ず主治医の判断を仰いでください。
Q2. LBPと、私が関心を持っている青黛(セイタイン)のような生薬は、どのように違いますか?
A. 生菌製剤(LBP)は、特定の働きを持つ腸内細菌を意図的に組み合わせて製剤化したもので、科学的に厳密な臨床試験を経て「医薬品」として承認を目指しています。一方、青黛のような生薬は、天然物由来の成分を含みますが、現在の日本の医療制度においては、潰瘍性大腸炎に対する「医薬品」として認可されていません。LBPは、安全性や有効性が公的に裏付けられた治療を目指している点が大きく異なります。
まとめとアクションプラン
潰瘍性大腸炎の治療は、腸内細菌を標的とする「精密医療」の時代へと進んでいます。今回のMRM Health社の生菌製剤(LBP)開発のニュースは、特に軽度から中等度UCの患者さんに大きな希望をもたらすものです。
- 生菌製剤(LBP)MH002は、糞便移植の次世代版であり、免疫を抑制しない経口薬として開発が進んでいます。
- 軽度から中等度のUC患者にとって、5-ASA製剤の次のステップとして、副作用リスクの低い新たな治療オプションとなる可能性があります。
- 実用化にはまだ時間がかかりますが、UC治療がQOL向上と負担軽減を目指して進化している明確な証拠です。
難病UCで治療に悩んでいる方は、次回の受診時に、「このニュースを見ましたが、私の場合はどうですか?」と主治医に聞いてみましょう。
免責事項と情報源
本記事は、MRM Health社のプレスリリースに基づき、情報提供を目的として作成されています。特定の治療法や薬剤の使用を推奨するものではありません。潰瘍性大腸炎の診断、治療方針の決定、および薬剤の選択については、必ず専門の医療機関で主治医と相談してください。自己判断による服薬の中断や治療の変更は、症状の悪化や重篤な合併症につながる危険があるため厳禁です。
参考リンク(一次情報):

コメント